ห้องปฏิบัติการเฉพาะทาง Autonomic Function Test
HRV ระบบประสาทอัตโนมัติ และการตรวจความผิดปกติ
การวินิจฉัย dysautonomia และ POTS ที่แม่นยำ เพื่อวางแผนการรักษาที่ตรงจุด
ต้องเตรียมตัวอย่างไรเมื่อตรวจ AFT?
- นอนหลับให้เพียงพอในคืนก่อนตรวจ
- งดกาแฟ เครื่องดื่มชูกำลัง และบุหรี่ อย่างน้อย 4–6 ชั่วโมงก่อนตรวจ
- งดยาบางชนิดตามคำแนะนำของแพทย์เจ้าของไข้
- สวมเสื้อผ้าที่เคลื่อนไหวง่าย และมาถึงก่อนเวลานัดเล็กน้อย
หากไม่แน่ใจเรื่องยาที่ต้องงด กรุณาปรึกษาแพทย์เจ้าของไข้ หรือโทรสอบถามห้องปฏิบัติการก่อนวันตรวจ
ภาพรวมระบบประสาทอัตโนมัติ
ระบบประสาทอัตโนมัติ (Autonomic Nervous System; ANS) เป็นระบบที่ควบคุมการทำงานพื้นฐานของร่างกายโดยที่เราไม่ต้องสั่ง เช่น การเต้นของหัวใจ ความดันโลหิต การย่อยอาหาร เหงื่อ และการไหลเวียนเลือดไปยังอวัยวะต่าง ๆ
ANS แบ่งออกเป็นสองระบบที่ทำงานควบคู่กัน ได้แก่ ระบบพาราซิมพาเทติก (parasympathetic) ซึ่งเกี่ยวข้องกับโหมดพัก–ฟื้นตัว และระบบซิมพาเทติก (sympathetic) ซึ่งเกี่ยวข้องกับโหมดเร่ง–ตอบสนองต่อความเครียด
การตรวจ HRV และการทดสอบ Autonomic Function Test ช่วยให้เราเห็นสมดุลของสองระบบนี้ได้อย่างเป็นรูปธรรมมากขึ้น
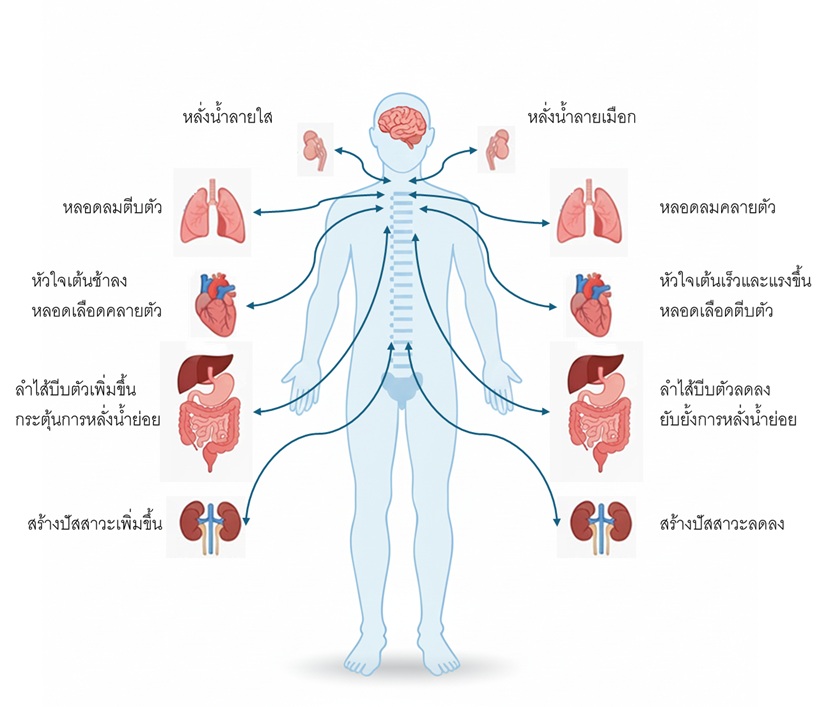
ภาพตัวอย่างการทำงานร่วมกันของระบบซิมพาเทติกและพาราซิมพาเทติกในอวัยวะสำคัญ เช่น หัวใจ หลอดเลือด ระบบย่อยอาหาร และรูม่านตา
เลือกเนื้อหาที่ต้องการ
เลือกแท็บด้านบนเพื่อดูคำอธิบายที่ออกแบบให้เหมาะกับกลุ่มผู้อ่านแต่ละกลุ่ม เนื้อหาทั้งหมดอ้างอิงหลักฐานวิชาการเดียวกัน
เมื่อไหร่ที่ควรพบแพทย์เพื่อตรวจระบบประสาทอัตโนมัติ?
- ลุกขึ้นแล้วหน้ามืด เวียนศีรษะ ใจสั่น เหงื่อออก
- เป็นลมหมดสติ โดยเฉพาะเวลาลุกจากท่านอน/นั่ง หรือในห้องน้ำ
- หัวใจเต้นเร็วผิดปกติแม้พักเฉย ๆ หรือเต้นเร็วมากเวลาลุกขึ้น
- ระบบย่อยอาหารแปรปรวน ท้องอืด แน่นท้อง หรือคลื่นไส้เรื้อรัง โดยไม่พบสาเหตุจากทางเดินอาหารชัดเจน
- เหงื่อที่มือออกง่าย หรือปลายมือปลายเท้าเย็นเป็นประจำ
- ปัสสาวะไม่ออก
หากคุณมีอาการเหล่านี้บ่อยหรือรบกวนการใช้ชีวิตประจำวัน ควรปรึกษาแพทย์ประจำตัว หรือแพทย์เฉพาะทางโรคหัวใจ/ระบบประสาท
การตรวจ Autonomic Function Test ทำอะไรบ้าง?
- ตรวจคลื่นไฟฟ้าหัวใจและความดันเลือดในขณะนอนและยืน
- ทดสอบการเปลี่ยนท่าทาง (active standing) เพื่อดูการตอบสนองของ peripheral sympathetic tone
- ทดสอบการหายใจเข้าออกลึก (deep breathing) เพื่อประเมินพาราซิมพาเทติก
- ทดสอบ Valsalva maneuver
ใช้เวลารวมประมาณ 2–3 ชั่วโมง ผู้ป่วยกลับบ้านได้หลังตรวจเสร็จได้ทันที
ข้อมูลสำหรับแพทย์ผู้ส่งต่อ (Clinical Autonomic Evaluation)
Standardized Test Battery
- Heart Rate Variability (HRV): วิเคราะห์ Time & Frequency Domain เพื่อประเมิน Sympathovagal Balance
- Deep Breathing Test: วัดความสามารถในการคุมชีพจรผ่าน Vagus Nerve (Cardiac Vagal Tone)
- Valsalva Maneuver (HR Analysis): คำนวณ Valsalva Ratio เพื่อประเมิน Baroreflex Integrity
- Active Standing: วิเคราะห์การตอบสนองของความดันและชีพจรต่อแรงโน้มถ่วง
- Isometric Handgrip Test: ทดสอบ Sympathetic Adrenergic Response (Vascular)
- Galvanic Skin Response (GSR): ประเมิน Sudomotor Function (Small Fiber Sympathetic Cholinergic)
- Bioelectrical Impedance (BIA): ประเมินภาวะขาดน้ำ (Hydration status) เพื่อลดผลรบกวน
Referral Guidelines
โปรดระบุโรคประจำตัว (เช่น DM, Parkinsonism, Sjogren's) และรายการยาที่ส่งผลต่อ Autonomic tone (Beta-blockers, Alpha-adrenergic agonists,Anti-parkinsons, Antihypertensives, Antidepressants) เพื่อความแม่นยำในการแปลผลเทียบกับ Clinical context
ตารางวิเคราะห์ความผิดปกติรายโรค (Disease-Specific Test Findings)
| กลุ่มโรค / สภาวะ | พยาธิสรีรวิทยา (Pathophysiology) | การเปลี่ยนแปลงที่พบจากการตรวจ (Expected Test Changes) |
|---|---|---|
|
Orthostatic Hypotension (nOH) (ความดันต่ำเมื่อลุกยืน) |
ความดันตัวบน (Systolic) ตกลง ≥ 20 mmHg หรือตัวล่าง (Diastolic) ≥ 10 mmHg ภายใน 3 นาทีแรก โดยที่ชีพจรเพิ่มขึ้นน้อยมาก (Blunted Heart Rate response) | ยืนยันความล้มเหลวของระบบ Sympathetic (Adrenergic Failure) และแยกออกจากภาวะขาดน้ำหรือยา |
| Multiple System Atrophy (MSA-P/C) | รอยโรคที่ Pre-ganglionic; เกิด Autonomic failure รุนแรงและครอบคลุมทุกระบบ |
• Active Standing: พบ Neurogenic OH (BP ตกอย่างรุนแรง >20/10 mmHg) โดยที่ HR ไม่เพิ่มขึ้น (Blunted response) • HRV / Deep Breathing: ค่า RMSSD, HF และ E:I Ratio ต่ำกว่าเกณฑ์มาก • Valsalva: Valsalva Ratio ต่ำผิดปกติ (< 1.2) • GSR: มักพบเหงื่อไม่ออก (Absent/Reduced response) ทั่วร่างกาย |
| Parkinson’s Disease (PD) | รอยโรคที่ Post-ganglionic; Autonomic involvement มักเกิดช้ากว่า MSA |
• ระยะแรก: ผลตรวจมักปกติ หรือพบ HRV ลดลงเล็กน้อยตามอายุ • ระยะท้าย: อาจพบ nOH และ HRV ต่ำลง แต่ความรุนแรงมักน้อยกว่า MSA ในช่วงเวลาเดียวกัน |
| Sjogren’s Syndrome / Small Fiber Neuropathy (SFN) | ทำลายเส้นประสาทขนาดเล็กที่คุมความรู้สึกเจ็บปวดและต่อมเหงื่อ |
• GSR: เป็นการตรวจที่สำคัญที่สุด; พบความผิดปกติของเหงื่อ (Sudomotor deficit) แม้ EMG/NCS จะปกติ • Handgrip: อาจพบ Sympathetic response ที่ลดลงได้ในบางราย |
| POTS (Orthostatic Intolerance) | ภาวะหัวใจเต้นเร็วเมื่อเปลี่ยนท่า โดยไม่มีความดันโลหิตต่ำ |
• Active Standing: HR เพิ่มขึ้น ≥ 30 bpm (หรือ ≥ 40 ในวัยรุ่น) ภายใน 10 นาที โดยที่ BP คงที่ • HRV: อาจพบ Sympathetic dominance (LF/HF ratio สูง) ในสภาวะพัก |
| Diabetes (DAN) | เส้นประสาทถูกทำลายจากน้ำตาลในเลือดสูง (Cardiac Autonomic Neuropathy) |
• Deep Breathing: พบการลดลงของ E:I Ratio เป็นสัญญาณแรก (Early sign) • HRV: ค่า RMSSD และ SDNN ลดลงอย่างมีนัยสำคัญ |
| Baroreflex Failure | ความเสียหายที่ Carotid sinus หรือเส้นประสาทคู่ที่ 9/10 |
• General Monitoring: พบ Labile BP (ความดันสวิงรุนแรง) • Valsalva: พบความผิดปกติในการคุม BP และ HR ในช่วง Phase II และ IV (Loss of compensation) |
สรุปประโยชน์ทางคลินิก (Clinical Value)
การตรวจ AFT ช่วยให้แพทย์สามารถแยกพยาธิสภาพระหว่าง Pre-ganglionic (MSA) และ Post-ganglionic (PD/PAF), วินิจฉัย Small Fiber Neuropathy (GSR) ในผู้ป่วย Sjogren's หรือเบาหวาน และยืนยันภาวะ POTS/nOH เพื่อวางแผนการรักษาด้วยยาอย่างแม่นยำ
สรุปประโยชน์ทางคลินิกสำหรับการส่งตรวจ (Clinical Value)
การตรวจ AFT ช่วยให้แพทย์สามารถ 1) วินิจฉัยโรคในระยะ Subclinical (โดยเฉพาะในเบาหวาน) 2) แยกแยะกลุ่มโรค Parkinsonism 3) ให้หลักฐานเชิงประจักษ์ (Objective evidence) ในรายที่อาการไม่ชัดเจน และ 4) วางแผนการรักษาด้วยยา ได้อย่างแม่นยำตามกลไกพยาธิสรีรวิทยาของผู้ป่วยแต่ละราย
References:
• Cheshire WP, et al. Electrodiagnostic assessment of the autonomic nervous system: A consensus statement. Clin Neurophysiol 2021.
• Heart rate variability: standards of measurement, physiological interpretation and clinical use. Circulation 1996.
HRV สำหรับนักกีฬา: อ่านค่าตัวเลขให้ลึกขึ้น
ในกลุ่มนักกีฬา HRV ใช้เป็นเครื่องมือดูทั้ง ความพร้อมของระบบประสาทอัตโนมัติ ภาวะเครียดจากการซ้อม และการฟื้นตัวของร่างกาย จุดสำคัญคือค่าทุกตัวควรแปลผลเทียบกับ ค่าเฉลี่ยของแต่ละคน (personal baseline) ไม่ควรนำค่าดิบไปเทียบข้ามคนโดยตรง
Time-domain indices (ระยะสั้น ~5 นาที)
-
RMSSD
สะท้อนกิจกรรมของพาราซิมพาเทติก (vagal tone) เป็นหลัก ใช้ดูการฟื้นตัวหรือการฝึกฝนร่างกายมากเกินไปได้ดี -
SDNN (short-term)
เป็นส่วนเบี่ยงเบนมาตรฐานของ NN intervals ในช่วงเวลาที่บันทึก ในการบันทึกสั้นมาก (เช่น 5 นาที) SDNN จะได้รับอิทธิพลจากระยะเวลาบันทึกมาก และสะท้อน “overall variability” น้อยกว่าการบันทึก 24 ชม. -
Total Power (TP)
กำลังรวมของสเปกตรัม HRV ในช่วงความถี่ที่วิเคราะห์ ใน short-term recording ใช้ดูแนวโน้ม “ระดับกิจกรรมโดยรวม” ของระบบประสาทอัตโนมัติร่วมกับ RMSSD และ HF
| แนวโน้มเมื่อเทียบกับ baseline | ความหมายเบื้องต้น |
|---|---|
| RMSSD / TP อยู่ในช่วงเดิมหรือสูงขึ้นเล็กน้อย | การฟื้นตัวมักเพียงพอ ภาระการซ้อมเหมาะสม |
| RMSSD ลดลงชัดเจน 3–5 วันต่อเนื่อง | สงสัยภาวะ fatigue/overreaching ควรพิจารณาลด intensity การซ้อมและเพิ่มวันพัก |
| HR ขณะพักสูงกว่าปกติ 5–10 bpm ร่วมกับ RMSSD ต่ำลง | อาจมีความเครียดทางกาย/ใจ การพักผ่อนไม่เพียงพอ หรือติดเชื้อระยะแรก |
Frequency-domain & ภาพรวมการแปลผล
-
HF (0.15–0.40 Hz)
สะท้อนพาราซิมพาเทติก โดยเฉพาะกิจกรรมที่สัมพันธ์กับการหายใจ -
LF (0.04–0.15 Hz)
เกี่ยวข้องกับ baroreflex และมีส่วนผสมของทั้ง sympathetic + parasympathetic -
LF/HF ratio
ใช้ดูแนวโน้มสมดุลโดยรวมได้บ้าง แต่ไม่ควรใช้ตีความเป็นตัวเดียว ควรดูร่วมกับค่า time-domain และบริบทการซ้อม/การนอนหลับ
ในภาพรวม นักกีฬาที่มีสุขภาพดีและซ้อมเหมาะสมมักมี HR ขณะพักค่อนข้างต่ำ ร่วมกับ RMSSD, HF และ total power อยู่ในช่วงปกติหรือสูงกว่าคนทั่วไปเล็กน้อย ค่า HRV สามารถแกว่งขึ้นลงตามภาระการฝึกซ้อมและความเครียดในชีวิตประจำวัน แต่ไม่ควรลดลงต่อเนื่องหลายวันแบบไม่มีเหตุผลชัดเจน
หมายเหตุ: การใช้ค่า HRV จากอุปกรณ์สวมใส่ (wearable) เพื่อปรับโปรแกรมการซ้อมควรอยู่ภายใต้คำแนะนำของผู้ฝึกสอนและบุคลากรทางการแพทย์ โดยเฉพาะในนักกีฬาที่มีโรคประจำตัวหรือมีอาการผิดปกติร่วมด้วย
Dr. Phoopha Series
เรื่องเล่าจากห้องฉุกเฉินของหมอภูผา
ผู้ป่วยที่ล้ม วูบ ใจสั่น เหงื่อไม่ออก หรือความดันตก — เรื่องที่หลายคนคิดว่า “ธรรมดา” แต่หมอภูผามองเห็นสัญญาณลึกกว่านั้นของระบบประสาทอัตโนมัติ
ผู้หญิงที่ไม่มีเหงื่อ
อ่านตอนเต็มยาที่ไม่ได้บอกหมอ
อ่านตอนเต็มหัวใจที่เต้นเร็วกว่าร่างกาย
อ่านตอนเต็มล้มด้วยแรงที่ไม่ใช่ความแก่
อ่านตอนเต็มวูบแรกในชีวิต
อ่านตอนเต็มเกลือหยดสุดท้าย
อ่านตอนเต็มคุยกันข้างลู่: HRV บนนาฬิกา
อ่านตอนเต็มเดินเซ – แยกอาการต่าง วินิจฉัยที่ถูกต้อง
อ่านตอนเต็มคำถามที่พบบ่อย (FAQ)
- การตรวจเจ็บไหม?
ส่วนมากไม่เจ็บ เป็นการวัดคลื่นไฟฟ้าหัวใจ ความดันเลือด และการเปลี่ยนท่าทาง - ใช้เวลานานเท่าไร?
ปกติใช้เวลาตรวจประมาณ 2–3 ชั่วโมง รวมเวลาพักระหว่างการทดสอบ - ตรวจแล้วต้องนอนโรงพยาบาลหรือไม่?
โดยทั่วไปสามารถกลับบ้านได้ในวันเดียว
งานวิจัยและความรู้เพิ่มเติม
รายการอ้างอิงตัวอย่างของงานวิจัยที่ใช้ Autonomic Function Test, Ewing’s battery และการวิเคราะห์ HRV ในผู้ป่วยกลุ่มต่าง ๆ
- Amir, B., Lanciano, S., Rubinshtein, R., & Nussinovitch, U. (2024). Autonomic responses in young females with typical vasovagal syncope. Internal and Emergency Medicine, 19, 1345–1351. https://doi.org/10.1007/s11739-024-03622-7
- Sztajzel, J. (2004). Heart rate variability: A noninvasive electrocardiographic method to measure the autonomic nervous system. Swiss medical weekly. https://doi.org/10.4414/smw.2004.10321
- Stein, P., Bosner, M., Kleiger, R., & Conger, B. M. (1994). Heart rate variability: A measure of cardiac autonomic tone. American heart journal. https://doi.org/10.1016/0002-8703(94)90059-0
- Forte, G., Favieri, F., & Casagrande, M. (2019). Heart rate variability and cognitive function: A systematic review. Frontiers in Neuroscience. https://doi.org/10.3389/fnins.2019.00710
- Catai, A., Pastre, C. M., Godoy, M., Silva, E., Takahashi, A., & Vanderlei, L. (2020). Heart rate variability: Are you using it properly? Standardisation checklist of procedures. Brazilian journal of physical therapy. https://doi.org/10.1016/j.bjpt.2019.02.006
- Draghici, A. E. & Taylor, J. A. (2016). The physiological basis and measurement of heart rate variability in humans. Journal of Physiological Anthropology. https://doi.org/10.1186/s40101-016-0113-7
- Hayano, J. & Yuda, E. (2019). Pitfalls of assessment of autonomic function by heart rate variability. Journal of Physiological Anthropology. https://doi.org/10.1186/s40101-016-0113-7
- Tian, G., Xiong, L., Leung, H., Soo, Y., Leung, T., & Wong, L. (2019). Reduced heart rate variability in mild-moderate ischemic stroke. Journal of Clinical Neuroscience. https://doi.org/10.1016/j.jocn.2019.03.003
- Gregoire, J., Gilon, C., Carlier, S., & Bersini, H. (2023). Autonomic nervous system assessment using heart rate variability. Acta Cardiologica. https://doi.org/10.1080/00015385.2023.2177371
- (2023). Heart rate variability as a translational dynamic biomarker of altered autonomic function in health and psychiatric disease. Biomedicines. https://doi.org/10.3390/biomedicines11061591
- Dhumad, M. M., Hamdan, F. B., Khudhair, M., & Al-Matubsi, H. (2021). Correlation of staging and risk factors with cardiovascular autonomic neuropathy in patients with type ii diabetes mellitus. Scientific Reports. https://doi.org/10.1038/s41598-021-80962-w
- Bellavere, F., Ragazzi, E., Chilelli, N., Lapolla, A., & Bax, G. (2018). Autonomic testing: Which value for each cardiovascular test? An observational study. Acta Diabetologica. https://doi.org/10.1007/s00592-018-1215-y
- Struhal, W., Mahringer, C., & Lahrmann, H. (2018). Heart rate spectra confirm the presence of autonomic dysfunction in dementia patients. Journal of Alzheimer's Disease.
- Ewing, D., Martyn, C., Young, R, & Clarke, B. (1985). The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care. https://doi.org/10.2337/diacare.8.5.491
- Gerritsen, J., Dekker, J., Tenvoorde, B. J., Kostense, P., Heine, R., Bouter, L., Heethaar, R, & Stehouwer, C. (2001). Impaired autonomic function is associated with increased mortality, Especially in subjects with diabetes, Hypertension, Or a history of cardiovascular disease: The hoorn study. Diabetes care. https://doi.org/10.2337/diacare.24.10.1793
- Zygmunt, A & Stańczyk, J. (2010). Methods of evaluation of autonomic nervous system function. Archives of Medical Science : AMS. https://doi.org/10.5114/aoms.2010.13500
- Hayano, J & Yuda, E. (2019). Pitfalls of assessment of autonomic function by heart rate variability. Journal of Physiological Anthropology. https://doi.org/10.1186/s40101-019-0193-2
- Allan, L., Ballard, C., Allen, J., Murray, A., Davidson, A., McKeith, I, & Kenny, R. (2006). Autonomic dysfunction in dementia. Journal of Neurology, Neurosurgery & Psychiatry. https://doi.org/10.1136/jnnp.2006.102343
- Aydemir, M., Yazısız, V., Başarıcı, I., Avcı, A., Erbasan, F., Belgi, A, & Terzioğlu, E. (2010). Cardiac autonomic profile in rheumatoid arthritis and systemic lupus erythematosus. Lupus. https://doi.org/10.1177/0961203309351540
- Ziegler, D., Laude, D., Akila, F, & Elghozi, J. (2001). Time- and frequency-domain estimation of early diabetic cardiovascular autonomic neuropathy. Clinical Autonomic Research. https://doi.org/10.1007/bf02292769
- Ghiasi, S., Greco, A., Barbieri, R., Scilingo, E, & Valenza, G. (2020). Assessing autonomic function from electrodermal activity and heart rate variability during cold-pressor test and emotional challenge. Scientific Reports. https://doi.org/10.1038/s41598-020-62225-2
- Cheshire, W., Freeman, R., Gibbons, C., Cortelli, P., Wenning, G., Hilz, M., Spies, J., Lipp, A., Sandroni, P., Wada, N., Mano, A., Kim, H. A., Kimpinski, K., Iodice, V., Idiaquez, J., Thaisetthawatkul, P., Coon, E., Low, P, & Singer, W. (2020). Normative values for cardiovascular autonomic function tests: Consensus statement on the recommendations of the american academy of neurology, The american autonomic society, And the international federation of clinical neurophysiology. Clinical Neurophysiology. https://doi.org/10.1016/j.clinph.2020.11.024